Gibt es eigentlich eine bevorzugte Farbe, in der astronomische Objekte leuchten? Oder sind alle Farben gleichberechtigt? Auch dieser Frage gingen wir am 8. Tag des VHS-Astronomiekurses nach. Die Lösung dieser Frage führt uns vom galaktischen Maßstab ins Allerkleinste – in die Quantenwelt.
Gibt es eigentlich eine bevorzugte Farbe, in der astronomische Objekte leuchten? Oder sind alle Farben gleichberechtigt? Auch dieser Frage gingen wir am 8. Tag des VHS-Astronomiekurses nach. Die Lösung dieser Frage führt uns vom galaktischen Maßstab ins Allerkleinste – in die Quantenwelt.
Das Licht unserer Sonne besteht aus eine Vielzahl von Farben, die zusammengenommen das bekannte weiße Sonnenlicht ergeben. Abhängig von Ihrer Oberflächentemperatur ist zwar gelbliches Licht am häufigsten; aber auch alle anderen Frequenzen des elektromagnetischen Spektrums sind reichlich vertreten. Und das gilt in ähnlicher Weise für alle anderen Sterne. Gibt es also gar keine bevorzugte Farbe?
Sterne sind in galaktischem Maßstab betrachtet relativ kompakte Objekte; jedoch mit hoher Strahlkraft. Interstellare Gaswolken hingegen, die mehrere zig Lichtjahre Durchmesser Ausdehnung besitzen können, sind zunächst unsichtbar; d.h. senden von alleine keine nennenswerte Strahlung aus. Das ändert sich jedoch, wenn Sterne ins Spiel kommen, die in diese Gaswolken eingebettet sein können und in sie hineinstrahlen. Dies trifft z.B. auf die galaktischen Sternengeburtsstätten zu; etwa den Orionnebel. Es gibt nun zwei Möglichkeiten der Wechselwirkung: Entweder reflektiert die Gaswolke das Sternenlicht oder sie absorbiert es und gibt diese absorbierte Energie erst später wieder frei. Im ersten Fall hat man es mit Reflexionsnebeln zu tun und im zweiten Fall mit Emissionsnebeln. Oder mit einer Kombination von Beidem.

Orionnebel M42 im dezenten Hα-Rot
Dass Sternenlicht als Energieform eingefangen, zwischengespeichert und zeitversetzt wieder abgegeben wird ist jedoch gar nicht so selten. In fast allen galaktischen Gaswolken, in denen Sterne eingebettet sind, tritt dieses Phänomen auf. Und hier kommen wir dem Geheimnis der Lieblingsfarbe des Universums auf die Spur…
Der Schlüssel liegt im Wasserstoff
Denn das immer noch bei Weitem vorherrschende Element des Universums ist Wasserstoff. Gasnebel bestehen daraus zu einen hohen Anteil. Doch was passiert mit Wasserstoffatomen, wenn sie intensiver Sternenstrahlung ausgesetzt sind?
Um das zu klären, müssen wir uns mit dem Aufbau von Wasserstoff beschäftigen. Es ist das am einfachsten aufgebaute chemische Element und besteht aus einem Proton im Kern und einem Elektron in seiner Hülle; nach außen ist es also elektrisch neutral. Doch wie das Elektron um das Proton herumfliegt, wird nicht nur durch die elektrischen Kräfte bestimmt, sondern durch eine eigenartige Wirkung, die ausschließlich in der subatomaren Welt des Allerkleinsten auftritt: Die Quantenmechanik. Wenn ausschließlich die Gesetze der elektromagnetischen Wechselwirkung gälten, würde das Elektron schon nach kurzer Zeit in den Kern stürzen, da es durch die Umkreisung des Atomkerns beständig Energie verlöre (Synchrotronstrahlung). Doch zum Glück passiert das nicht und das Wasserstoffatom – und jedes andere Atom – ist in seiner Hülle stabil.
Der Abstieg von Lichtjahren zu Nanometern
Die Ursache liegt in der Wirkung der quantenmechanischen Seltsamkeiten. Denn sie erlauben nur bestimmte Abstände und Energieniveaus, die das Elektron um den Atomkern einnehmen kann. Wenn das Atom also von außen einem Energiestoß ausgesetzt wird, springt das Elektron in der Atomhülle von einer Anfangsbahn zu einer höheren. Nach einiger Zeit verlässt das Elektron diese Bahn wieder und fällt auf eine niedrigere Bahn zurück. Die Energie, die dabei frei wird, wird in Form eines ‚Lichtquants‘ (oder Photon) mit eben dieser Energie und somit einer festen Wellenlänge abgestrahlt.
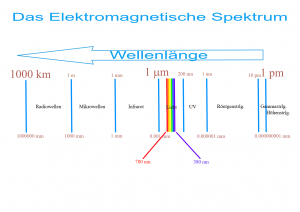
Die meisten dieser Photonen besitzen beim Wasserstoff relativ hohe Energien und sind als Ultraviolettstrahlung für das menschliche Auge unsichtbar. Wiederum andere haben eine zu geringe Energie; sie werden als Mikrowellenstrahlung abgestrahlt. Doch es gibt eine bestimmte Sorte von Elektronensprüngen innerhalb des Wasserstoffatoms, die für das menschliche Auge sichtbare Licht abstrahlen: Es sind die Sprünge vom 6., 5., 4. und 3. Energieband in das zweitniedrigste Energieband. Sie erzeugen violette, blauviolette, grünblaue und rote Photonen.
Am häufigsten unter den sichtbaren Übergängen beim Wasserstoff sind jedoch die Photonen vom 3. in das 2. Energieband. Sie haben relativ zum 2. Energieband den geringsten Energieunterschied zurückzulegen und strahlen damit das langwelligste, für das menschliche Auge sichtbare Licht aus: Es ist das berühmt-berüchtigte rote Hα-Licht, in der viele Gasnebel leuchten. Alle Photonen dieses Energiebandes haben exakt die gleiche Wellenlänge von 656,28 Nanometer (0,00000065628 Meter oder 0,00065628 Millimeter).
Aufgrund des häufigen Vorkommens von Wasserstoff ist also die Farbe rot die vorherrschende Farbe von Emissionsnebeln.
Wie oben schon angedeutet, gibt es noch weitere sichtbare Photonen, die in energetisch angeregten Wasserstoffwolken vorkommen: Grünblaue Photonen vom Elektronenrücksprung von der 4. in die 2. Energiebahn (Hβ-Licht) , blauviolette Photonen (Hγ) von der 5. in die 2. Energiebahn und violette. Diese Hδ-Photonen vom tiefen Sprung vom 6. in die 2. Energiebahn liegen bereits am kurzwelligen Ende des sichtbaren Spektrums. Alle diese sind jedoch nicht so häufig anzutreffen wie unsere roten Hα-Photonen.
Fazit: Man kann also mit unserem Vorwissen das Hα-Rot mit Fug und Recht als Lieblingsfarbe des Universums betrachten.